いのちのバトン 薬はみんなで作るもの パートIII
NPO法人ブーゲンビリア設立15周年記念事業 第6回アジア乳がん患者大会
 2012年11月3日、東京大学にて、乳がんの患者団体「NPO法人ブーゲンビリア」と東京大学医学部の主催で、「いのちのバトン 薬はみんなで作るもの パートIII」と題したシンポジウムが開催されました。すべての患者にとって新薬開発への期待は多大です。シンポジウムでは、そのための重要な過程である「臨床試験・治験」に焦点を当て、医療・行政関係者やアジア各国の患者団体が集い、日本で臨床試験・治験を推進していくために何をなすべきか、熱い議論が行われました。
2012年11月3日、東京大学にて、乳がんの患者団体「NPO法人ブーゲンビリア」と東京大学医学部の主催で、「いのちのバトン 薬はみんなで作るもの パートIII」と題したシンポジウムが開催されました。すべての患者にとって新薬開発への期待は多大です。シンポジウムでは、そのための重要な過程である「臨床試験・治験」に焦点を当て、医療・行政関係者やアジア各国の患者団体が集い、日本で臨床試験・治験を推進していくために何をなすべきか、熱い議論が行われました。
まねきねこでは後日、関係者4名にインタビューを実施。臨床試験・治験の日本における現状や課題、展望についてお話を伺いました。
がん臨床試験・治験について患者・市民の視点で考える
会場には150名近くの国際色豊かな参加者が集いました。第一部の基調講演では東京大学大学院医学系研究科教授の宮川清医師から、がん研究の概略や、「根治性を高める」「症状を軽減する」の2つの方向性で研究を活性化し、さまざまな分野での連携を深めることが大切であると説明されました。さらに国立がんセンター中央病院企画戦略局長の藤原康弘医師からは、がん臨床試験・治験についての基礎知識として、抗がん剤の開発の流れ、新薬開発にかかる膨大な時間と莫大なコスト、承認審査を経て販売までの過程について解説されました。
第二部では日本、韓国、台湾、タイのアジア4ヶ国の乳がん患者団体の代表が各国の事情を報告。臨床試験・治験で、どのようなアドボカシー活動(社会的弱者からの権利主張を代弁すること・患者からの政策提言)を行っているか、正確な情報提供、医療費負担の各国の状況、アドボカシーによって改善された医療・社会環境や、患者自身の成長などが紹介されました。またブーゲンビリアが行った「薬」ならびに「治験」に関するアンケート結果も発表されました。(次ページ参照) 第三部では、医療関係者、患者団体、マスコミなどが、さまざまな立場から議論を展開。アメリカにおける患者・家族に正確な情報を伝えるための充実したスタッフ教育について、日本におけるCRC(治験コーディネーター)の現状といった最新の話題や、マスコミも医療機関も情報の出しっ放しになっていないか振り返る必要がある、またどのセクションでも予算・人材が壁になっているのでそこをいかに工夫していくかが大切などといった多くの意見が出されました。そして、「医療は国民の共有財産であり、日本は皆保険という世界に誇れる制度を持っている。臨床試験や治験を通してより良い医療が生まれていくために、一人ひとりに何ができるのか考えていこう」と結びました。
がん医療における「薬」ならびに「治験」に関するアンケート
結果から見えてきたもの
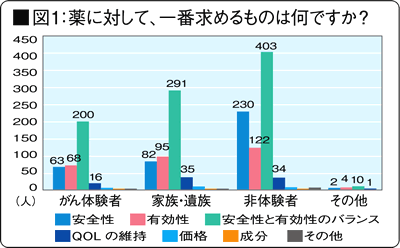
薬に対して、一番求めるものは何ですか?※図1
「安全性と有効性のバランス」という回答が第1位。「QOL(生活の質)の維持」が少数なのには、我慢強い国民性、あるいは薬にそれを求めてはいけないのではないかという意識が感じられる。
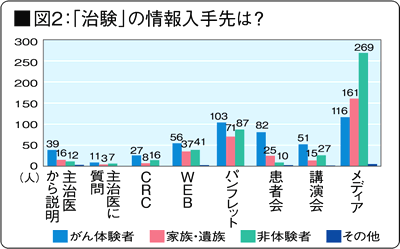
「治験」情報の入手先は?※図2(治験をよく理解している、知っていると答えた人からの回答)
50%以上が「メディアの報道を見た(新聞・TV・雑誌等)」と回答。メディアは正しくわかりやすい情報、治験当事者の声を反映した情報を伝えているのか。
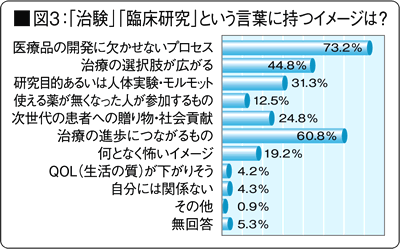
「治験」「臨床試験」という言葉に持つイメージは?※図3(優先順に3つ)
「医薬品開発には欠かせないもの」などと前向きに捉えている人が多い一方で、「研究目的」「何となく恐い」などマイナスイメージの回答も少なくない。
アンケート結果をふまえた今後に向けての提言
1.ウェブ等で治験情報を患者・家族にわかりやすく公開
2.治験情報のわかりやすい冊子作成と、必要としている人に届くような配布方法の工夫
3.各病院で実施している治験について、患者向けにわかりやすく情報開示
4.全国治験よろず電話相談センターの設置
5.被保険者保護法の法制化(国際的な基準に合致したガイドラインの法整備)と、それに伴う事務作業担当者の増員
6.CRC(治験コーディネーター)等の専門職の増員と、その職務に専念できる環境整備
7.臨床試験を行う医師へ優遇措置をとりキャリアアップを図る
8.各医療機関の治験審査委員会等の事務書類の書式統一
9.治験についての解説に際して、生命倫理患者の利益が守られるべき事を明文化
アンケートの実施概要
実施期間:2012年9月〜10月
対象:ブーゲンビリア会員、一般市民、全国の患者団体リーダー、講演会・学習会等の参加者
配布数:2500枚
回収数:1556枚
●アンケートの結果からのピックアップ/コメントはブーゲンビリアの報告より抜粋。
インタビューから
未来の患者に、治験を通してキャンサーギフトを届けたい
NPO法人 ブーゲンビリア 理事長 内田 絵子 さん
私は1993年、家族でシンガポールに住んでいた時に乳がんを発症し、手術を受けました。インフォームドコンセントやセカンドオピニオン、初期段階からの緩和ケアなど、本当に人間の尊厳を大切にする患者主体の医療に出会いました。その医療に感謝と恩返しがしたいという思いから、98年に乳がんの患者団体、ブーゲンビリアを立ち上げました。
 当会には「癒し」「学び」「国際ボランティア」「提言活動」という4つの柱があります。「国際ボランティア」は、私がアジアの多くの医師、看護師に命を救ってもらった経験から各国の患者団体と交流を始め、2007年からアジア乳がん患者大会を開催しています。
当会には「癒し」「学び」「国際ボランティア」「提言活動」という4つの柱があります。「国際ボランティア」は、私がアジアの多くの医師、看護師に命を救ってもらった経験から各国の患者団体と交流を始め、2007年からアジア乳がん患者大会を開催しています。
「癒し」である定例のおしゃべり会では「新薬ができれば……」という声がよく聞かれます。誰もがカリスマ医師に出会えるわけではなく、地域によって医療格差もある。けれども薬は日本全国、平等に届きます。その薬は世界中の患者さんの治験への参加があったからこそ承認・販売されています。そこで当会の勉強会で治験について学ぶことになりました。
勉強会を始めるまで、多くの会員が創薬には治験が必須ということさえ知らず、治験に対して漠然としたマイナスイメージを抱いていました。どうすれば治験の情報が得られるのか、医師に治験をすすめられたときはどうすればいいのか、患者の権利は守られているのか。まずは正しい知識を集め、そこから患者、市民としてできることは何かを学んできました。
2012年は団体設立15周年ということもあり、「いのちのバトン 薬はみんなで作るもの」というひとつのテーマで3回のシンポジウムを開催し、これで治験についての勉強は一区切りと考えていたのですが、実際にはやっと入口に立ったという思いです。医療関係者や厚生労働省、製薬会社、マスコミの方々のお話を聞くことで、日本で治験が進まない状況や課題がわかってきました。また、アンケートを実施したことで、患者や家族、一般の方々が治験に対してどんな意見を持っているのかも見えてきました。
ブーゲンビリアとしては、正しい情報をわかりやすく一般に発信し、そしてより良い治験が行われる環境の整備のために、患者の立場から国への提言活動を続けていきます。私たちが今、生きているのは世界中のがん患者さんたちのキャンサーギフトのおかげ。治験をしっかりと理解して協力し、未来の患者に私たちもキャンサーギフトを届けていきたいと願っています。
日本国内での治験環境を整備し、自国での創薬推進を
国立がん研究センター中央病院 企画戦略局長 乳腺・腫瘍内科科長 藤原 康弘 さん
臨床試験や治験(※1)の情報がわかりにくいという声は私たちもよく聞きます。国や医療機関のホームページにしても、だれもがアクセスしやすい環境にはつくられていないという状況もあります。大規模な国際共同治験や第III相の治験となると情報は得やすくなりますが、最初の第Ⅰ相(※2)になるとより難しいと言えるでしょう。
日本は創薬立国として世界の主要5ヶ国のひとつを占めています。基礎研究では素晴らしい能力を持ち、医療技術も高く、高度な医療機器も揃っています。けれども新薬の開発過程の後半、つまり治験や臨床試験を経て承認、製品化に至る部分が弱い。なぜならこれまでその部分を海外に依存してきたからです。
日本という国は政策として治験や臨床試験のインフラ整備を積極的にしてこなかったのです。治験や臨床試験は非常に手間と時間のかかる仕事で、医師以外にもCRC(※3)など高度な専門職が必要です。常に医療従事者が不足している現在の日本で、臨床試験や治験に熱心な病院が増えないのも当然でしょう。このままではますます日本国内での創薬は衰退していきます。
その流れを止めるパワーを持っているのは患者さんの声だと私は思います。
がんに関してもそうですが、これまで患者さんはドラッグラグを問題視してきました。その結果、この問題は近年大きく改善されています。今後はいかに日本で治験を増やしていくかという点に、その声を上げていってほしい。ブーゲンビリアさんのシンポジウムには、議員や厚生労働省の方も出席され、患者や国民の声を国に届ける素晴らしい機会になっていると思います。
創薬は国の安全保障です。自国でつくった薬で自国民の健康を守るという根本的な考え方を国が政策としてしっかりと持つ。そのために臨床試験・治験のインフラ整備を進め、患者さんが十分に理解・納得して参加でき、正確なデータを迅速に収集・分析できるシステムづくりとマンパワーの養成が必要です。 国立がん研究センターは2011年、厚生労働省から「早期・探索的臨床試験拠点」に選定され「早期・探索臨床研究センター(通称 エポック)」を発足しました。薬の素であるシーズ探索から早期臨床開発まで一貫して行うシステムを構築していこうというものです。研究所・医療機関・製薬企業・大学、そして患者・市民の協働で取り組んでいきたいと考えています。
正確でわかりやすい情報提供で、患者さんの声を施策に生かしていく
厚生労働省 医政局 研究開発振興課長 佐原 康之 さん
研究開発振興課の大きな仕事のひとつとして、日本で臨床研究(臨床試験を含めたより広い概念)や治験を活性化していくための環境整備や企画などが挙げられます。2011年度までの5年間、文部科学省・厚生労働省の共同による「新しい治験活性化5か年計画」に基づき、治験拠点病院の体制整備、CRC養成などの治験に関するスタッフの充実、治験手続きの効率化に取り組みました。
 さらに国民への情報提供・啓発活動では、日本医師会など複数機関から発信されている臨床試験・治験情報を、国立保健医療学院のホームページ「臨床研究(試験)情報検索」のポータルサイト(※4)に一本化し、公開しています。それでも今、国内でどんな治験が進行し、参加するにはどうすればいいか、一般の人に十分に情報が届いていないという声が多いのも事実です。このため、さらに利用しやすいポータルサイトに改善すべく、患者ニーズの発掘を開始しています。そこではブーゲンビリアさんのアンケート調査も活用させていただくことになっています。
さらに国民への情報提供・啓発活動では、日本医師会など複数機関から発信されている臨床試験・治験情報を、国立保健医療学院のホームページ「臨床研究(試験)情報検索」のポータルサイト(※4)に一本化し、公開しています。それでも今、国内でどんな治験が進行し、参加するにはどうすればいいか、一般の人に十分に情報が届いていないという声が多いのも事実です。このため、さらに利用しやすいポータルサイトに改善すべく、患者ニーズの発掘を開始しています。そこではブーゲンビリアさんのアンケート調査も活用させていただくことになっています。
これらの事業を経て、2012年度から「臨床研究・治験活性化5か年計画」がスタートしました。これまでは治験について国民の理解を得る施策を優先していましたが、これに、さらに臨床研究が加わりました。
日本では、新薬開発などのための治験と、医療機関の倫理委員会や厚生労働省の臨床研究倫理指針に基づいて行われる臨床研究とがあります。また、治験は主に製薬会社というスポンサーがいますが、医師主導の臨床研究は予算面でも医師をサポートするマンパワー面でも厳しいのが現状です。厚生労働省としては製薬会社が実施する治験だけでなく、適用外使用の拡大、他の治療法との組み合わせなど、さまざまな臨床研究が動いていき、トータルで治療が進歩していくことが重要だと考えています。そのために、医師主導の臨床研究への支援を強化しています。また、ここ10年間で、国の施策決定に患者団体の意見が反映されるようになってきました。大きな変化です。治験・臨床研究の活性化のために、患者さんの声を大いに役立てていきたいと考えています。
新しい治療の開発には、患者さんの協力が不可欠です
東京大学医科学研究所附属病院 緩和医療科 特任講師 岩瀬 哲 さん
まずは、新薬の開発目的の治験と、医師主導の臨床試験の違いを理解してほしいと思います。臨床試験という分野の中のひとつとして治験があります。たとえば新薬が開発され、その薬の適用拡大を科学的に証明していく場合は臨床試験になります。さらに服薬のタイミングや放射線治療、手術などの組み合わせでより効果的な治療法を探るなど、臨床試験の目的は非常に多岐にわたります。
私は普段、臨床での緩和ケアを行っていますが、同時に緩和ケアの臨床試験を支援するデータセンター構築と運営も担当しています。緩和ケアでの臨床試験とは、たとえばがん患者さんの痛み、吐き気、倦怠感などを対象に運動をするというケアを組み合わせてみようとなると、参加してくれる患者さんを募り、運動をするグループとしないグループに分けて科学的に検証していくというものです。
すべての臨床試験は、医師や研究者が計画書を立案し、その機関の倫理委員会に諮り、許可が出て初めてスタートします。学会などを通して公表され、全国の施設が参加する場合もあります。臨床試験への登録は、医師と患者の信頼関係で成り立っています。治験と同様に、医師は検査や治療の内容、参加することのメリットやデメリットを十分に説明し、患者さんが理解・納得して決めます。ただ、臨床試験はまだ治験ほど一般の人に馴染みがなく、十分な登録人数が得られないケースも多々あります。
私たち医師が患者団体に期待することは、臨床試験について学ぶ機会を持ち、情報をわかりやすく発信し、登録が進むように協力していただくということです。たとえば臨床試験の経験者が体験を話す、ピアサポートのような場や機会があればいいのではないでしょうか。薬と一緒で、治療法もまた患者さんの協力なくしては開発していけない。それを理解していただければと願っています。
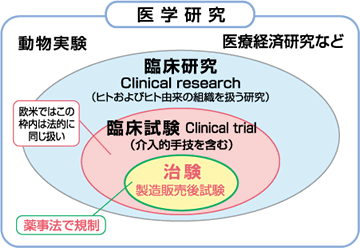
※1 臨床試験と治験
臨床試験には、薬事法に基づいて行われる新薬開発などのための「治験」と、厚生労働省の臨床研究倫理指針などに基づいて行われる「治験以外の臨床試験」とがあります。
●臨床試験
さまざまな治療法(手術や放射線などとの組み合わせも含め)の安全性や有効性を調べる試験。
●治験
厚生労働省から新薬承認を目的とし、未承認薬を用いて主に製薬企業が行う臨床試験のひとつが治験と呼ばれている。
※2 第Ⅰ相
未承認薬の、ヒトでの有効性や安全性について調べる治験は3段階(第Ⅰ相〜第III相)に分かれる。第Ⅰ相(PhaseⅠ・フェイズⅠ)は健康な成人を対象に、副作用、吸収の速さ、体外に排出されるまでの時間などを調べる。
※3 CRC(clinical research coordinator、臨床研究コーディネーター)
医師の指導のもと治験に関する文書作成、スケジュール管理、患者サポートなどを行う専門職。
※4 国立保健医療学院ホームページ
「臨床研究(試験)情報検索」ポータルサイト
取材を終えて
まねきねこの視点
シンポジウム取材を端緒に、患者団体を取り巻く人たちのつながり「まねきねこサークル」として企画しましたが、臨床試験・治験はヘルスケア関連団体にとって非常に重要なテーマであり、今後の活動課題として検討していくことも念願に置いての今回の拡大企画となりました。
さまざまな立場でのお話の中で共通していたのは、患者が声を発し、届けることの有効性でした。創薬も、新しい治療法の開発も、患者の協力なくては成し得ない。国の施策をも含めた大きなテーマですが、この事実のもとに、臨床試験・治験のキーワードで患者団体が疾患を超えてつながり、患者の声を大きくしていければ・・・。それぞれの団体やVHO-netの地域学習会でも学びを通して気持ちを高めて行くことが大切だと感じました。